武内 寛明
Hiroaki TAKEUCHI Ph.D.
准教授 / Associate Professor
htake.molv at tmd.ac.jp
スポーツ、音楽鑑賞
Zoonosis, Genetic Control of Lentivirus Susceptibility in Human Cells

経歴
2003年東北大学大学院医学系研究科博⼠課程終了。医学博士。東北 大学では、小柳義夫教授(現・京都大学ウイルス学研究所教授)の御指導のもと、 ウイルス伝播直後の患者血清から分離されたヒト免疫不全ウイルス(HIV-1)を 用いてHIV-1 感染伝播のメカニズムの解析を行いました。’03〜’06年までは、米 国国立衛生研究所・アレルギー/感染症部門(NIH/NIAID)visiting fellow(Dr. Klaus Strebel 研究室)。サル免疫不全ウイルス(SIV)のヒトへの種間感染伝播メ カニズムの研究を行いました。’07〜’10年までは東京大学医科学研究所・感染症 国際研究センター特任助教。アメリカ留学時の研究を更に発展させ、SIV のヒト への種間感染伝播メカニズムの研究を行いました。’11年東京医科歯科大学医歯 学総合研究科ウイルス制御学分野助教。’17年東京医科歯科大学医歯学総合研究 科ウイルス制御学分野講師。現在に至る。ウイルス研究を通じて生命の謎を解き 明かしたいと日々奮闘しています。
研究概要
はじめに
病原体が個体内に侵入すると、これに対する免疫防御反応が発動され、病原体を駆逐しようとします。世界的に流行しているエイズの原因であるヒト免疫不全ウイルス(human immunodeficiency virus: HIV)も例外ではありません。現在までに、ヒト体内におけるHIVの増殖を抑制する方法として、HIV生活環を標的とした薬剤が開発されてきました。抗HIV剤は、ウイルス生活環において、①吸着・侵入、②逆転写、③組込み、④-⑤翻訳・粒子形成の各過程を標的としたものがあります(図1)。そして、これら異なる標的に対する薬剤を組み合わせて併用することで、より効果的なウイルス複製制御が可能となってきました。しかし、薬剤併用化学療法による薬剤耐性株の出現や長期服用による副作用が認められること、更にはこの方法をもってしても、体内からウイルスを完全に排除する事が出来ないのが現状です。感染拡大予防に必須と考えられているエイズワクチン開発研究においては、機能的かつ量的に十分なウイルス特異的細胞傷害性Tリンパ球(HIV-specific CTL)を誘導する方法が期待されているものの、有効なワクチン開発への戦略は未だ確立されていのが現状です。HIV感染症の予防および治療法を開発するにあたり、個体レベルにおける宿主適応免疫系および細胞レベルでのウイルス増殖機構の更なる解明とその制御法の開発が急務となっています。私たちは、HIV感染制御ヒト宿主因子(群)を同定することにより、新規エイズ治療法に向けての基盤確立に寄与することを目的とした研究を推し進めています。
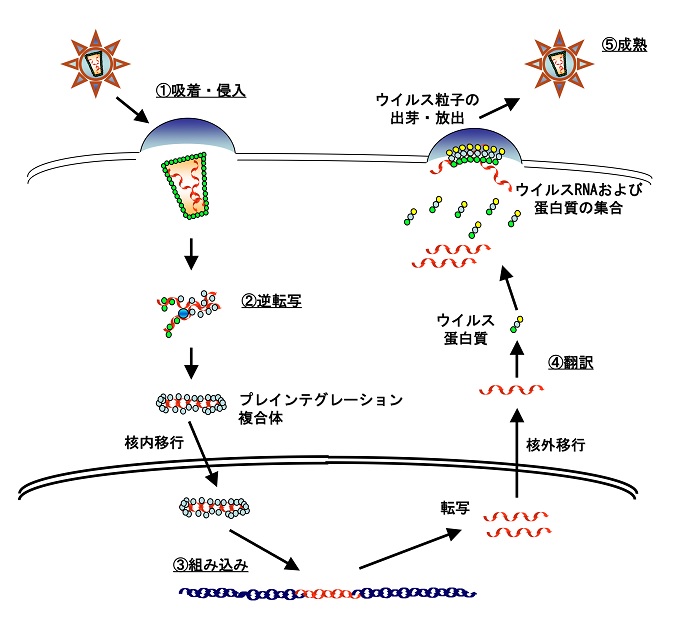
HIVはTリンパ球やマクロファージ等の免疫担当細胞の細胞膜表面上に発現しているCD4分子とケモカイン受容体とを利用して吸着し、標的細胞内に侵入します。侵入後は、逆転写反応によってウイルスRNAからDNAが合成され、細胞核内に移行した後、標的細胞の染色体DNAに組み込まれます。組み込まれたプロウイルスDNAは、細胞由来の転写複製機構を利用してウイルスRNAの転写およびウイルスタンパク質を合成し、細胞膜表面上にてウイルス粒子を構築した後に、子孫ウイルスとして細胞外へ放出されます。
1)ゲノムワイドshRNAスクリーニング法によるHIV-1感染制御因子(群)の網羅的探索
現在までにヒトゲノム情報に立脚したHIV-1感染制御宿主因子探索法として、small interfering RNA (siRNA)によるRNA干渉法を用いたgenome-wide screening法による研究成果が幾つか報告されているが、HIV-1感染標的細胞であるTリンパ球およびマクロファージ等を用いたものではなく、そのため自然感染におけるHIV-1感染伝播での役割については不明な点が多いのが現状です。私たちは、HIV-1感染標的細胞であるTリンパ球を用いて機能遺伝子発現抑制Tリンパ球ライブラリーを構築し、HIV-1感染制御因子群を同定することを試みています。
siRNAを用いた機能遺伝子発現抑制Tリンパ球ライブラリーを構築する際には、幾つか問題点があります。一つ目は、「Tリンパ球へのsiRNA遺伝子導入効率が非常に低いこと」が挙げられ、HIV-1感染標的細胞を用いたgenome-wide screeningを困難なものとしています。二つ目は、「1細胞あたりのsiRNA導入量(種類)を制御出来ないこと」が挙げられます。このことは、目的の表現型を持つ細胞(群)が単離されても、その細胞内に多種のsiRNAが存在していることで、その表現型を反映する機能遺伝子に辿り着くまでに時間と労力を要することを示唆しています。そこで、これらの問題点を克服する為には、「Tリンパ球への遺伝子導入効率を上げること」、「導入される遺伝子量(種類)を制御すること」の条件が必要になると考えられます。現段階でこれらの条件を満たすことが出来る材料および方法の一つとして、レンチウイルスベクターを用いた遺伝子導入法が挙げられます。レンチウイルスベクターは、Tリンパ球を含む浮遊細胞や非分裂細胞等に遺伝子導入が可能であり、ゲノムDNAへの目的遺伝子の組み込みステップでは、遺伝子組み込み量がある程度制限されるというレンチウイルスの特徴が生かされています*。そこで、レンチウイルスベクターによるgenome-wide shRNA screeningが可能なMISSION LentiPlex Human short hairpin RNA (shRNA) Libraries(Sigma-Aldrich)を用いて、機能遺伝子発現抑制T細胞ライブラリーを構築し、HIV感染制御因子探索を行っています(図2)。
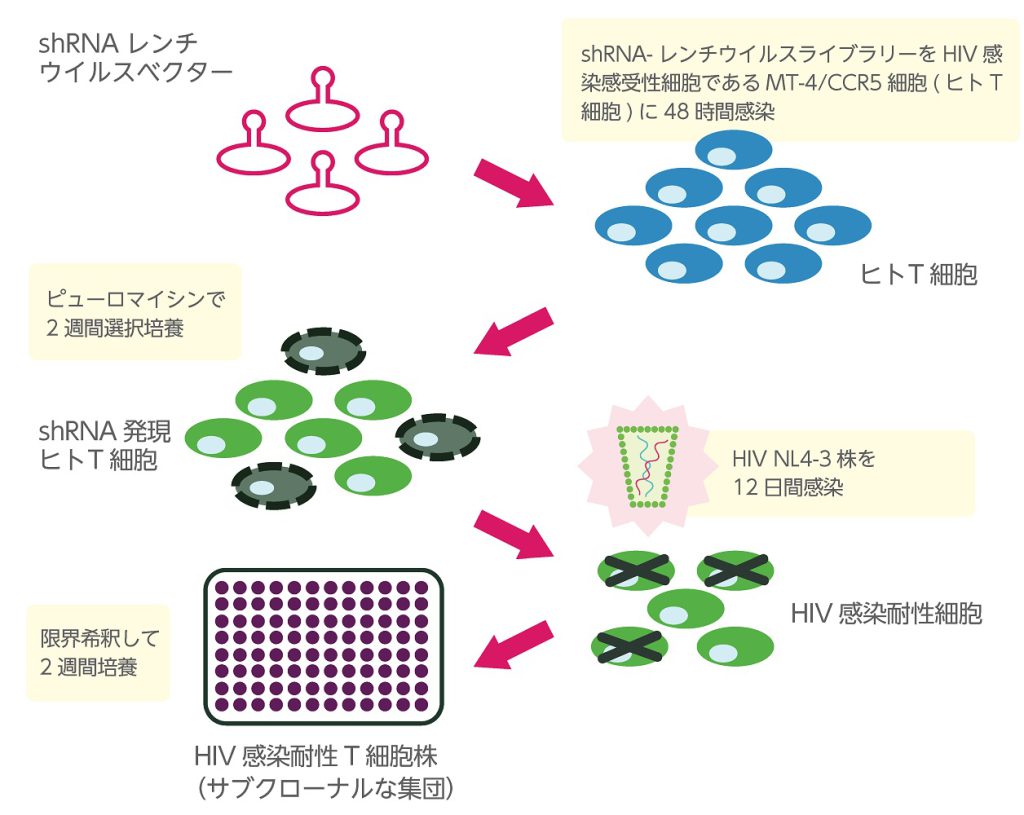
ヒト機能遺伝子(約1万8千遺伝子)を標的としたshRNAライブラリーによる機能遺伝子発現抑制T細胞株を作製するため、HIV感染感受性T細胞であるMT4C5細胞をライブラリー作製細胞として選択した。様々な感染条件を検討した結果、1 x 10^5個のMT4C5細胞にMOI=10に相当するshRNA-レンチウイルスライブラリーを48時間感染させた。shRNA発現カセットには、ピューロマイシン耐性遺伝子が含まれていることを利用して、shRNA発現カセットが組み込まれた細胞を選択する目的で、感染48時間後にピューロマイシン(1 µg/ml)を含む培地と交換し、更に2週間選択培養を行った後に、T細胞株ライブラリーを樹立した。その後、樹立したT細胞株ライブラリーを用いて、HIV NL4-3株(MOI = 0.001)を感染させた。感染12日後にHIV感染耐性細胞を限界希釈し、更に2週間培養することで、HIV感染耐性T細胞株を得た。
上記の方法によりHIV-1感染制御宿主因子群の一つとして見出されてきた宿主リン酸化酵素:Maternal Embryonic Leucine Zipper Kinase(MELK)が、長らく謎であったHIV-1コア構造体崩壊の制御を、コア構造体の段階的リン酸化を通じて担っていることをつきとめました(図3)(PLoS Pathog, 2017)。本研究成果は、変異しやすいウイルス由来酵素タンパク質ではなく宿主側感染制御因子を標的とした新規エイズ治療法開発への応用が期待できます。さらには、 宿主タンパク質:eukaryotic translation initiation factor 4A isoform 2 (eIF4A2)が、逆転写反応過程を制御する新たな宿主因子として機能していることをつきとめました(Microbes infect, 2018)。
このように、「HIV-1 と宿主とのせめぎあい」を次々と明らかにしていくことは、HIV-1感染動態の理解の深化に貢献するだけでなく、新たなHIV-1 治癒に向けた基盤確⽴に貢献するものと考えます。
MELK 研究成果インタビュー記事
https://m-hub.jp/biology/1859/103-1
http://www.qlifepro.com/news/20170711/reveal-host-proteins-important-for-infection-of-aids-virus.html
http://www.tmd.ac.jp/cmn/soumu/kouhou/bloom!/vol.24/research_worker27.pdf
http://www.tmd.ac.jp/english/artis-cms/cms-files/Press_10.pdf
https://www.nikkei.com/article/DGXMZO36797000T21C18A0000000/
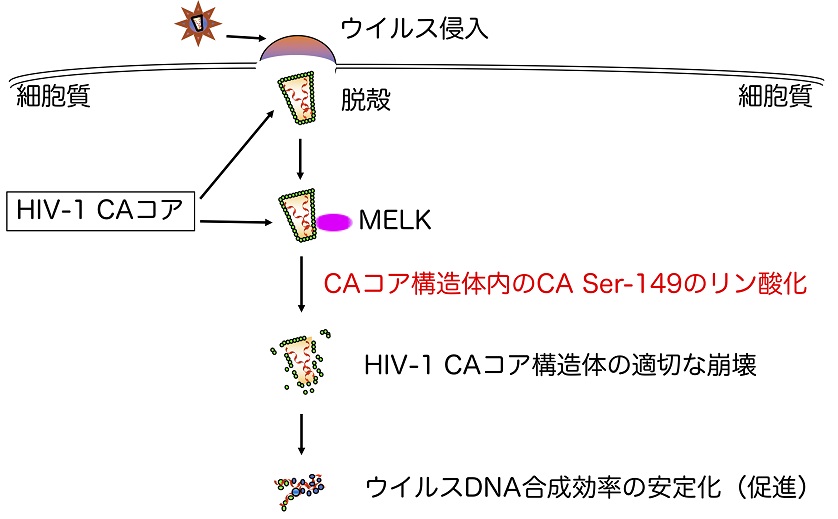
- HIV-1は、CD4陽性Tリンパ球やマクロファージに感染し、感染細胞内にタンパク質でできた殻(コア構造体)を放出します(脱殻)。
- コア構造体内にはウイルス遺伝子であるRNAや逆転写酵素等が内包されており、ウイルスDNA合成の場を提供します。
- ウイルスDNA合成ステップには、コア構造体が「適切なタイミング」で崩壊する必要があります。
- MELKはコア構造体を形成するHIV-1キャプシドタンパク質(HIV-1 CA)の特定アミノ酸残基(149番目のセリン残基:CA Ser-149)を段階的にリン酸化することによりHIV-1コア構造体崩壊制御を行っていることを明らかにしました。
2)ゲノムワイドshRNAスクリーニング法によるHIV-1潜伏感染制御因⼦(群)の網羅的探索
HIV 感染症の治癒(HIV cure)に向けた最⼤の問題点は、現状の抗HIV 剤併用療法(combination antiretroviral therapy: cART)では排除できないHIV が生体内に存在していることです。このHIV は、①抗HIV 剤が⽣体内において行き届かない場所に存在するHIV、②抗HIV 剤が効かなくなった薬剤耐性HIV、もしくは③感染細胞内のプロウイルスからの転写活性レベルが低い状態、すなわち潜伏感染状態のHIV(HIV リザーバ)のいずれかの特徴を有しています。HIV リザーバは、T 細胞および単球もしくはマクロファージといったHIV 感染標的細胞がリザーバ細胞へと変遷を遂げたものであり、T細胞リザーバではウイルスの活性化と潜伏化がダイナミックに変化していると考えられるのに対し、単球およびマクロファージ細胞リザーバではウイルスが⻑期的かつ安定的に潜伏化し、感染個体におけるウイルスリザーバ維持に貢献していると考えられます。
現時点において、リザーバ細胞からウイルスをたたき出すことでウイルス感染細胞を体内から排除する、”Kick and Kill”または”Shock and Kill”といった治療法の開発が試みられています。しかしながら、現⾏のcART を超える治療効果が得られていないのが現状です。その理由として、(1)プロウイルス再活性化誘導剤(Latency-Reversing Agent: LRA)として⽤いられているものが、広範な遺伝⼦発現上昇効果を⽰すもの(Broad activator)であり、プロウイルス特異的な再活性化効果を⽰すものではないこと、(2)Broad activator の効果を持ってしてもプロウイルス再活性化に⾄らないリザーバ細胞集団が存在すること、などが挙げられます。これらのことは、HIV 潜伏感染維持およびプロウイ ルス再活性化メカニズムの更なる理解が必要であることを⽰唆しており、その理解が「プロウイルス特異的再活性化誘導剤の開発および効果的なHIV 治癒法の基盤確立」に繋がるものと考えられます。
私たちは、潜伏感染状態を安定的に維持することが可能な単球系細胞を用いてHIV-1 潜伏感染モデル細胞株(THP-1 Nluc 細胞)を樹立し、新たな再活性化誘導剤(LRA)探索に用いるとともに、この細胞を利用した機能遺伝子発現抑制THP-1 Nluc 細胞ライブラリーを作製して潜伏感染維持メカニズムに寄与する宿主側要因の探索および同定を進めています。
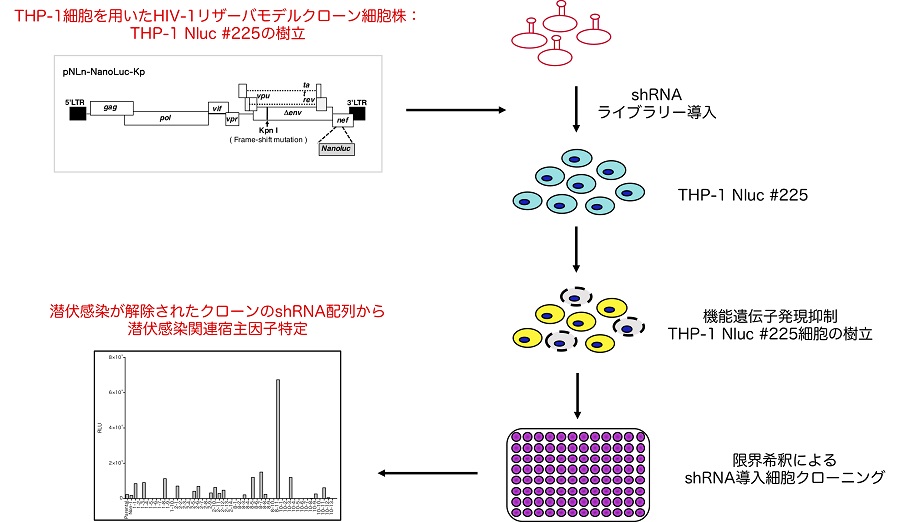
単球系HIV-1 潜伏感染モデル細胞株(THP-1 Nluc #225)細胞を用いて、ヒト機能遺伝⼦(約1 万8 千遺伝⼦)を標的としたshRNA ライブラリーによる機能遺伝⼦発現抑制THP-1 Nluc #225 細胞株ライブラリーを作製した。その後、細胞株ライブラリーを限界希釈し、多数のプロウイルス再活性化クローン細胞を得た。
3)サルエイズウイルスのヒトへの種間感染伝播に関わるウイルス側・宿主側制御因子の相互作用機構に関する解析
世界的に流行しているエイズの原因であるHIVは、サルエイズウイルス(Simian Immunodeficiency Virus: SIV)が「種の壁」を乗り越え病原性を示すHIVへと変貌を遂げた歴史的背景が明らかとなってきています。しかし、SIVがヒトに感染し病原性を示すようになった原因については、未だ解明されていない部分が多く残されています。私たちは、これまでにSIVがヒトへ感染伝播する際に作用する、3つのSIV増殖抑制ヒト宿主因子を同定してきました(J Biol Chem. 2005, J Virol. 2007, Retrovirology, 2012)。その内の2つは、HIVがヒトに感染する際にはHIV増殖抑制効果を示さないことから、サルからヒトへ感染する際に効力が発揮される宿主特異的なメカニズムであることが考えられます。このような宿主因子を探索および機能解析を行うことは、個体内でのHIV増殖機構および変異出現メカニズムを解明するために必要不可欠であると考えられます。現在、SIVがヒト細胞への感染伝播に必須なウイルス側領域について、gag領域内における数アミノ酸残基レベルで規定されていることを明らかにしており、その詳細な解析を進めています(図4)。
SIV野生株は、ヒトおよびサル細胞内で増殖可能であるが、gag領域におけるSIV変異株については、サル細胞のみ効率よく増殖可能である。
英文論文(2016年 - )
- Maeda K*§., Das D., Kobayakawa T., Tamamura H., and Takeuchi H*§. Discovery and Development of anti-HIV Therapeutic Agents: Progress Towards Improved HIV Medication. Curr Top Med Chem. in press.
- Aziati DI., Yoshida T., Hamano A., Maeda K., Takeuchi H., and Yamaoka S. PATZ1 is required for efficient HIV-1 infection. Biochem Biophys Res Commun. 514(2): 538-544.2019.
- Horiguchi Y., Goda T., Matsumoto A., Takeuchi H., Yamaoka S., and Miyahara Y. Gold nanoparticles with ligand/Zwitterion hybrid layer for individual counting of Influenza A H1N1 subtype using resistive pulse sensing. Langmuir 35(5): 1798-1806. 2019.
- Suzuki N., Yoshida T., Takeuchi H., Sakuma R., Sukegawa S., and Yamaoka S. Robust enhancement of lentivirus production by promoter activation. Sci Rep. 8(1):15036. 2018.
- Ndzinu KJ*., Takeuchi H*§., Saito H., Yoshida T., and Yamaoka S§. eIF4A2 is a host factor required for efficient HIV-1 replication. Microbes infect. 20 (2018): 346-352. 2018.
本論⽂は、Microbes and Infection のHighlighted Article に選定されました。
https://www.journals.elsevier.com/microbes-and-infection/highlighted-articles/highlighted-articles-june-2018-microbes-and-infection
- Gohda J., Suzuki K., Liu K., Xie X., Takeuchi H., Inoue J., Kawaguchi Y., and Ishda T.BI-2536 and BI-6727, dual Polo-like kinase / bromodomain inhibitors, effectively reactivate latent HIV-1. Sci Rep. 8(1):3251. 2018.
- Hai W., Goda T., Takeuchi H., Yamaoka S., Horiguchi Y., Matsumoto A., and Miyahara Y. Human Influenza Virus Detection Using Sialyllactose-Functionalized Organic Electrochemical Transistors. Sens Actuators B Chem. 260 (2018):635-641. 2018.
- Osako M., Itsumi M., Yamaguchi H., Takeuchi H., and Yamaoka S. A20 restores phorbol ester-induced differentiation of THP-1 cells in the absence of nuclear factor-κB activation. J Cell Biochem. 119(2): 1475-1487. 2018.
- Yoshida T., Hamano A., Ueda A., Takeuchi H., and Yamaoka S. Human SMOOTHENED inhibits human immunodeficiency virus type 1 infection. Biochem Biophys Res Commun. 493(1):132-138. 2017.
- Saito H., Takeuchi H*§., Masuda T., Noda T., and Yamaoka S§. N-terminally truncated POM121C inhibits HIV-1 replication. PLoS ONE12(9):e0182434. 2017.
- Takeuchi H*§., Saito H., Noda T., Miyamoto T., Yoshinaga T., Terahara K., Ishii H., Tsunetsugu-Yokota Y., and Yamaoka S§. Phosphorylation of the HIV-1 capsid by MELK triggers uncoating to promote viral cDNA synthesis. PLoS Pathog. 13(7):e1006441. 2017.
本論文は、PLOS PathogensのFeatured Research Articleに選定されました。
※東京医科歯科大学プレスリリースはこちら
※日本医療研究開発機構(AMED)プレスリリースはこちら
※国際プレスリリース(EurekAlert! / AAAS)はこちら
- Hai W., Goda T., Takeuchi H., Yamaoka S., Horiguchi Y., Akira M., and Miyahara Y. Specific Recognition of Human Influenza Virus with PEDOT Bearing Sialic Acid-Terminated Trisaccharides. ACS Appl Mater Interfaces. 9(16): 14162-14170. 2017.
- Horiguchi Y., Goda T., Matsumoto A., Takeuchi H., Yamaoka S., and Miyahara Y. Direct and Label-free Influenza Virus Detection Based on Multisite Binding to Sialic Acid Receptors. Biosens Bioelectron. 92: 234-40. 2017.
英文論文(2011 - 2015年)
- Sukegawa S., Sakuma R., Ohmine S., Takeuchi H., Ikeda Y., and Yamaoka S. Suppressor of Cytokine Signaling 1 Counteracts Rhesus Macaque TRIM5-Induced Inhibition of Human Immunodeficiency Virus Type-1 Production. PLoS ONE 9(10) e109640. 2014.
- Sugiyama R., Abe M., Nishitsuji H., Murakami Y., Takeuchi H., and Takaku H. Induction of heat-shock protein 70 by prostaglandin A1 inhibits HIV-1 Vif-mediated degradation of APOBEC3G. Antiviral Res. 99(3):307-11. 2013.
- Hori T*., Takeuchi H*§., Saito H., Sakuma R., Inagaki Y., and Yamaoka S§. A carboxy-terminally truncated human CPSF6 lacking residues encoded by exon 6 inhibits HIV-1 cDNA synthesis and promotes capsid disassembly. J Virol. 87(13):7726-36. 2013.
- Sakuma R and Takeuchi H*§. SIV replication in human cells. Front Microbiol. 3:162. 2012.
- Takeuchi H*§., Ishii H., Kuwano T., Inagaki N., Akari H., and Matano T. Host cell species-specific effect of cyclosporine A on simian immunodeficiency virus replication. Retrovirology. 9(1):3. 2012.
- Sugiyama R., Nishitsuji H., Furukawa A., Katahira M., Habu Y., Takeuchi H., Ryo A., and Takaku H. Heat shock protein 70 inhibits HIV-1 Vif-mediated ubiquitination and degradation of APOBEC3G. J Biol Chem. 286(12):10051-7. 2011.
- Ohmine S., Sakuma R., Sakuma T., Thatava T., Takeuchi H., and Ikeda Y. The antiviral spectra of TRIM5α orthologues and human TRIM family proteins against lentiviral production. PLoS ONE . 6(1) e16121. 2011.
英文論文(2006 - 2010年)
- Iwamoto N., Tsukamoto T., Kawada M., Takeda A., Yamamoto H., Takeuchi H., and Matano T. Broadening of CD8+ cell responses in vaccine-based simian immunodeficiency virus controllers. AIDS. 24(18):2777-87. 2010.
- Inagaki N., Takeuchi H., Yokoyama M., Sato H., Ryo A., Yamamoto H., Kawada M., and Matano T. A structural constraint for functional interaction between N-terminal and C-terminal domains in simian immunodeficiency virus capsid proteins. Retrovirology. 7:90. 2010.
- Takeuchi H*§. Contribution of Cyclophilin A to determination of simian immunodeficiency virus tropism: A progress update. Vaccine. 28 Suppl 2:B51-4. 2010.
- Kawada M., Tsukamoto T., Yamamoto H., Iwamoto N., Kurihara K., Takeda A., Moriya C., Takeuchi H., Akari H & Matano T. Gag-specific cytotoxic T-lymphocyte-based control of primary simian immunodeficiency virus replication in a vaccine trial. J Virol. Oct;82(20):10199-206. 2008.
- Takeuchi H*§ and Matano T. Host factors involved in resistance to retroviral infection. Microbiol Immunol. Jun;52(6):318-25. 2008.
- Goila-Gaur R., Khan MA., Miyagi E., Kao S., Opi S., Takeuchi H., and Strebel K. HIV-1 Vif promotes the formation of high molecular mass APOBEC3G complexes. Virology. Mar;372(1):136-146. 2008.
- Miyagi E., Opi S., Takeuchi H., Khan MA., Goila-Gaur R., Kao S., and Strebel K. Enzymatically Active APOBEC3G Is required for Efficient Inhibition of HIV-1. J Virol. Dec;81(24):13346-53. 2007.
- Kao S., Goila-Gaur R., Miyagi E., Kahn MA., Opi S., Takeuchi H., and Strebel K. Production of infectious virus and degradation of APOBEC3G are separable functional properties of human immunodeficiency virus type 1 Vif. Virology. Dec;369(2):329-39. 2007.
- Takeuchi H*., Buckler-White A., Goila-Gaur R., Miyagi E., Khan MA., Opi S., Kao S., Sokolskaja E., Pertel T., Luban J., and Strebel K. Vif counteracts a cyclophilin A-imposed inhibition of Simian immunodeficiency viruses in human cells. J Virol. Aug;81(15):8080-8090. 2007.
- Opi S., Kao S., Goila-Gaur R., Khan MA., Miyagi E., Takeuchi H., and Strebel K. Human immunodeficiency virus type 1 Vif inhibits packaging and antiviral activity of a degradation-resistant APOBEC3G variant. J Virol. Aug:81(15):8236-8246. 2007.
- Khan MA., Goila-Gaur R., Opi S., Miyagi E., Takeuchi H., Kao S., and Strebel K. Analysis of the contribution of cellular and viral RNA to the packaging of APOBEC3G into HIV-1 virions. Retrovirology. Jul 16;4(1):48. 2007.
- Iwatani Y., Takeuchi H*., Strebel K., and Levin JG. Biochemical activities of highly purified, catalytically active human APOBEC3G: correlation with antiviral effect. J Virol. Jun;80(12):5992-6002. 2006.
- Eda Y., Murakami T., Ami Y., Nakasone T., Takizawa M., Someya K., Kaizu M., Izumi Y., Yoshino N., Matsushita S., Higuchi H., Matsui H., Shinohara K., Takeuchi H., Koyanagi Y., Yamamoto N., and Honda M. Anti-V3 Humanized Antibody KD-247 Effectively Suppresses Ex Vivo Generation of Human Immunodeficiency Virus Type 1 and Affords Sterile Protection of Monkeys against a Heterologous Simian/Human Immunodeficiency Virus Infection. J Virol. Jun;80(11):5563-70. 2006.
- Opi S., Takeuchi H*., Kao S., Khan MA., Miyagi E., Goila-Gaur R., Iwatani Y., Levin LG., and Strebel K. Monomeric APOBEC3G is catalytically active and has antiviral activity. J Virol. May;80(10):4673-82. 2006.
英文論文(2000 - 2005年)
- Habu Y., Nagawa T., Matsumoto N., Takeuchi H., Miyano-Kurosaki N., and Takaku H. Suppression of human immunodeficiency virus type 1 (HIV-1) replication by an HIV-1-dependent double locked vector with the Cre/loxP system. Nucleosides Nucleotides Nucleic Acids. 24(10-12):1907-17. 2005.
- Khan MA., Kao S., Miyagi E., Takeuchi H., Goila-Gaur R., Opi S., Gipson CL., Parslow TG., Ly H., and Strebel K. Viral RNA is required for the Association of APOBEC3G with HIV-1 Nucleoprotein Complexes. J Virol. May;79(9):5870-4. 2005.
- Takeuchi H*., Kao S., Miyagi E., Kahn MA., Buckler-White A., Plishka R., and Strebel K. Production of infectious SIVagm from human cells requires functional inactivation but not viral exclusion of human APOBEC3G. J Biol Chem. Jan 7;280(1):375-82. 2005.
- Kao S., Miyagi E., Khan MA., Takeuchi H., Opi S., Goila-Gaur R., and Strebel K. Production of infectious human immunodeficiency virus type 1 does not require depletion of APOBEC3G from virus-producing cells. Retrovirology. Sep 17;1(1):27. 2004.
- Miyano-Kurosaki N., Barnor JS., Takeuchi H., Owada T., Nakashima H., Yamamoto N., Matsuzaki T., Shimada F., and Takaku H. In vitro and in vivo transport and delivery of phosphorothioate oligonucleotides with cationic liposomes. Antivir Chem Chemother. Mar;15(2):93-100. 2004.
- Kuwasaki T., Hatta M., Takeuchi H., and Takaku H. Inhibition of human immunodeficiency virus 1 replication in vitro by a self-stabilized oligonucleotide with 2'-O-methyl-guanosine-uridine quadruplex motifs. J Antimicrob Chemother. Apr;51(4):813-9. 2003.
- Habu Y., Miyano-Kurosaki N., Nagawa T., Matsumoto N., Takeuchi H., and Takaku H. Inhibition of HIV-1 replication by an HIV-1 dependent ribozyme expression vector with the Cre/loxP (ON/OFF) system. Antivir Chem Chemother. 13(5):273-81. 2002.
- Takeuchi H*., Suzuki Y., Tatsumi M., Hoshino H., Daar ES., and Koyanagi Y. Isolation and characterization of an infectious HIV-1 molecular clone from a patient with primary infection. AIDS Res. Hum. Retroviruses. 18(15): 1127-1133. 2002.
- Inagawa T., Nakashima H., Karwowski B., Guga P., Stec WJ., Takeuchi H., and Takaku H. Inhibition of Human Immunodeficiency Virus Type-1 replication by P-stereodefined oligo(nucleoside phosphorothioate)s in a long-term infection model. FEBS Lett. 528(1-3):48-52. 2002.
- Nagawa T., Habu Y., Matsumoto N., Takeuchi H., Miyano-Kurosaki N., and Takaku H. Development of HIV-1 dependent gene expression vector with the Cre/loxP (ON) system. Nucleic Acids Res Suppl. 2:295-6. 2002.
- Yukita M., Kitano M., Miyano-Kurosaki N., Takeuchi H., Nashimoto M., and Takaku H. RNA cleavage by a mammalian tRNA 3' processing endoribonuclease (3'tRNase) reduces HIV-1 expression. Nucleic Acids Res Suppl. 2: 297-8. 2002.
- Suzuki J., Miyano-Kurosaki N., Kuwasaki T., Takeuchi H., Kawai G., and Takaku H. Inhibition of human immunodeficiency virus type 1 activity in vitro by a new self-stabilized oligonucleotide with guanosine-thymidine quadruplex motifs. J Virol. 76: 3015-3022. 2002.
- Habu Y., Miyano-Kurosaki N., Takeuchi H., Matsumoto N., Tamura Y., and Takaku H. Inhibition of HIV-1 replication by the Cre-loxP hammerhead ribozyme. Nucleosides Nucleotides Nucleic Acids. 20(4-7): 723-726. 2001.
- Kitano M., Barnor JS., Miyano-Kurosaki N., Endo Y., Yukita M., Takeuchi H., Tamura Y., Takai K., Nashimoto M., and Takaku H. Effective suppression of HIV-1 gene expression by a mammalian tRNA 3' processing endoribonuclease and external guide sequence oligozymes. Nucleosides Nucleotides Nucleic Acids. 20(4-7): 719-722. 2001.
- Kitano M., Miyano-Kurosaki N., Endo Y., Yukita M., Takeuchi H., Tamura Y., Takai K., Nashimoto M., and Takaku H. Effective suppression of HIV-1 gene expression by a mammalian tRNA 3' processing endoribonuclease and external guide sequence oligozymes. Nucleic Acids Symp Ser. 44: 207-8. 2000.
英文論文(1999年以前)
- Habu Y., Takeuchi H*., Tamura Y., Miyano-Kurosaki N., Takai K., and Takaku H. Development of an HIV-1-dependent expression vector with the Cre/loxP system. Nucleic Acids Symp Ser. 42: 295-296. 1999.
- Suzuki J., Miyano-Kurosaki N., Takeuchi H., Tamura Y., Kawai G., Takai K., Tanaka Y., Tanaka R., Yamamoto N., and Takaku H. Phosphorothioate G3T4G3 motifs inhibit the early stage of HIV-1 infection. Nucleic Acids Symp Ser. 42: 227-228. 1999.
- Hosoya T., Takeuchi H*., Kanesaka Y., Yamakawa H., Miyano-Kurosaki N., Takai K., Yamamoto N., and Takaku H. Sequence-specific inhibition of a transcription factor by circular dumbbell DNA oligonucleotides. FEBS Lett. 19;461(3): 136-140. 1999.
- Tsukahara S., Suzuki J., Goto Y., Inagawa T., Takeuchi H., Takai K., Koyanagi Y., Yamamoto N., and Takaku H. Inhibition of gene expression by oligonucleotides forming triple-helices with the polypurine tract of HIV-1. Nucleic Acid Res. Symp. Ser. 35:181-182, 1996.
* Main contribution
§ Corresponding author
英文著書
- Sakuma R and Takeuchi H*§. Retroviral Host Cell Factors: APOBEC3G, TRIM5, and Cyclophilins. HIV and AIDS - Updates on Biology, Immunology, Epidemiology and Treatment Strategies ISBN 978-953-307-665-2:183-196. 2011.
* Main contribution
§ Corresponding author
和文論文
- 武内 寛明*§. 新規HIV-1 感染制御宿主因⼦の同定およびその機能解明. The Journal of AIDS Research(⽇本エイズ学会誌)20: 117-123, 2018.
- 武内 寛明*§.エイズウイルスの異種間感染メカニズム. The Journal of AIDS Research(日本エイズ学会誌)11(2): 104-105, 2009.
- 武内 寛明*§、俣野 哲朗. エイズウイルスの増殖機構の解析とその制御法の開発. 蛋白質 核酸 酵素(共立出版). 54(8): 947-952, 2009.
- 武内 寛明*§、俣野 哲朗. 動物エイズモデルの研究はどこまで進んだか. 治療学(ライフサイエンス出版). 42(5): 85-91, 2008.
- 武内 寛明*、小柳 義夫. HIV感染とリンパ球アポトーシス. 臨床免疫(科学評論社). 37(2):210-215, 2002.
- Miyano-Kurosaki N and Takeuchi H. Introduction of ribozyme in mammalian cells by retroviral vector. Antisense. 2(2): 57-64, 1998.
*Main contribution
§Corresponding author
受賞歴
- 2017年
日本エイズ学会ECC 山口メモリアルエイズ研究奨励賞
http://www.tmd.ac.jp/news/20180112/index.html
https://www.amed.go.jp/news/seika/jyusho/20171214.html - 2017年
東京医科歯科大学 免疫学・病態生化学領域合同シンポジウ ム 最優秀発表賞 - 2017年
東京医科歯科大学 免疫学・病態生化学領域合同シンポジウム 優秀若手研究奨励賞 - 2014年
第17回日本レトロウイルス研究会夏期セミナー(SRC)Best Presentation Award - 2006年
米国NIHフェロー研究優秀賞 [The Fellows Award for Research Excellence (FARE) of National Institutes of Health (NIH), USA] - 2005年
米国NIHフェロー研究優秀賞 [The Fellows Award for Research Excellence (FARE) of National Institutes of Health (NIH), USA] - 2002年
第5回日本レトロウイルス研究会夏期セミナー(SRC)Best Presentation Award
研究奨励
- 2015年
公益信託今井保太郎記念エイズ研究奨励 - 2015年
武田科学振興財団医学系研究奨励(感染症) - 2007年
上原記念生命科学財団研究奨励
国際学会(口頭発表)
- Takeuchi H*§. The timing and triggering of uncoating in an early stage of HIV-1 infection: the essential role of MELK for optimal capsid core disassembly. Special AMR seminar at St. Vincent’s Centre of Applied Medical Research, Sydney, Australia, 2017.
- Takeuchi H*§. The timing and triggering of HIV-1 uncoating: the essential role of MELK for optimal capsid core disassembly. U.S-Japan Cooperative Medical Sciences Program (USJCMSP) AIDS Panel Meeting, Washington DC, USA, 2016.
- Saito H, Takeuchi H*§ and Yamaoka S. N-terminally truncated POM121C, a component of nuclear pore complexes, inhibits HIV-1 replication. Cold Spring Harbor Laboratory Meeting on Retroviruses, New York, USA, 2015.
- Takeuchi H*§, Saito H, Miyamoto T, Yoshinaga T, Ishii H and Yamaoka S. AMPK-RPK is a host essential factor for optimal capsid disassembly to promote viral cDNA synthesis during the early stage of HIV-1 infection. Cold Spring Harbor Laboratory Meeting on Retroviruses, New York, USA, 2014.
- Takeuchi H*§. Species-specific Effect of Cyclosporine A on Simian Immunodeficiency Virus Replication: Possible Contribution of Cyclophilins to the Determination of Viral Tropism. China-Japan Research Collaboration on Emerging and Reemerging Infections, Beijing, China, 2009.
- Takeuchi H*§., Ishii H and Matano T. Cyclophilin B has an inhibitory effect on SIV but not HIV-1 replication in human cells. Cold Spring Habor Laboratory Meeting on Reroviruses, New York, USA, 2009.
- Takeuchi H*§., Ishii H, Kuwano T, Inagaki N, Akari H and Matano T. Contribution of cyclophilin A to determination of simian immunodeficiency virus tropism. The 8th Awaji International Forum on Infection and Immunity, Awaji Island, Japan, 2008.
- Takeuchi H*§., Inagaki N, Ishii H, Kuwano T, Akari H and Matano T. Cyclophilin A affects SIV replication positively in monkey but negatively in human cells. Cold Spring Habor Laboratory Meeting on Reroviruses, New York, USA, 2008.
- Takeuchi H*., and Strebel K. Vif Counteracts a Cyclophilin A-Dependent Restriction of Simian Immunodeficiency Viruses in Human Cells. American Society of Cell Biology Meeting on The Cell Biology of HIV-1 and Other Retroviruses, Atlanta, USA, 2006.
- Takeuchi H*., and Strebel K. SIVagm Vif targets a novel APOBEC-independent viral restriction factor in human cells. Cold Spring Habor Laboratory Meeting on Reroviruses, New York, USA, 2005.
- Takeuchi H*., Kao S., Miyagi E., Khan MA., Bucker-White A., Plishka R., Goila-Gaur R., Opi S., Luban J., and Strebel K. Multiple restrictions to SIVagm replication in human cells. HIV Drug Resistance Program; Think Tank Meeting, Frederick, USA, 2005.
- Takeuchi H*., Kao S., Miyagi E., Khan MA., and Strebel K. Inhibition of APOBEC3G by SIVagm does not involve viral exclusion of the deaminase. Cold Spring Habor Laboratory Meeting on Retroviruses, New York, USA, 2004.
国際学会(ポスター発表)
- Takeuchi H*§, Sakuma R and Yamaoka S. HIV-1 replication is modulated by host AMPK-related protein kinase expression levels in human cells. Cold Spring Harbor Laboratory Meeting on Retroviruses, New York, USA, 2012.
- Inagaki N, Takeuchi H* and Matano T. Functional interaction between N-terminal and C-terminal domains in simian immunodeficiency virus capsid proteins. The 10th Awaji International Forum on Infection and Immunity, Awaji Island, Japan, 2010.
- Takeuchi H*§., Ishii H and Matano T. Species-specific effect of cyclosporine A on simian immunodeficiency virus replication: possible contribution of cyclophilins to the determination of viral tropism. The 9th Awaji International Forum on Infection and Immunity, Awaji Island, Japan, 2009.
- Takeuchi H*., Buckler-White A., Gaur R., Miyagi E., Khan MA., Opi S., Luban J., and Strebel K. SIVagm Vif inhibits the encapsidation of Cyclophilin A and increase the infectivity of SIVagm virions. Keystone Symposia on HIV pathogenesis, Denver, USA, 2006.
- Takeuchi H*., and Strebel K. SIVagm Vif overcomes a viral restriction in APOBEC-deficient human cells and inhibits encapsidation of two non-APOBEC host factors into SIVagm virions. Keystone Symposia on HIV pathogenesis, Banff, Canada, 2005.
- Takeuchi H*., Montoya D., Kao S., Miyagi E., Kahn MA., Plishka R., Bucker-White A., and Strebel K. Inactivation of APOBEC3G by HIV and SIV Vif proteins. Keystone Symposia on HIV pathogenesis, Keystone, Canada, 2004.
- Takeuchi H*., Suzuki Y., Daar ES., Shimizu N., Hoshino H., and Koyanagi Y. Genetic and biological polymorphism of HIV-1 during acute infection. Cold Spring Harbor Laboratory Meeting on Retroviruses, New York, USA, 2002.
- Kurosaki N., Takeuchi H., and Takaku H. Delivery and transport of antisense oligonucleotides against HIV-1 in vitro and in vivo. HIV DART 2000, Dec. 19, 2000, Puerto Rico.
- Takaku H., Habu Y, Takeuchi H., Miyano-Kurosaki N., Tamura Y., and Takai K. Inhibition of HIV-1 replication by the cre-loxP hammerhead ribozyme. 13th International Conference on Antiviral Research, Apr. 18, 2000, Baltimore, USA.
- Kurosaki N., Koyanagi Y., Suzuki Y., Takeuchi H., Habu Y., Kanbara K., Takai K., Takaku H., and Yamamoto N. Inhibition of HIV-1 expression through the action of hammerhead ribozymes driven by tRNA promoter. IBC’s 5th Annual International Conference of Antisense, Feb. 2, 1998, Colonado, USA.
*Main contribution
§Corresponding author
国内学会(シンポジウム講演およびワークショップ発表)
Hiroaki Takeuchi*§.
Dynamics and Regulation of HIV-1 Uncoating and Nuclear Movements of HIV-1 Complexes: Our Recent Advances and Future Perspectives. CAIDS/ACC/ARC Joint Symposium(発表言語:英語)(2018年11月10日、東京)
武内 寛明.
HIV-1 コア・サイエンス ~HIV-1 コア(キャプシドコア)崩壊プロセスおよび
HIV-1 複合体コア(核)移行プロセスのさらなる展望~第31 回日本エイズ学会学術集会
(2017年11月24-26日、東京)
シンポジウム講演
武内 寛明.
HIV-1キャプシドコア構造体崩壊を制御する宿主因子群 ~それらの理解の深化からHIV-1感染制御への展望~
第30回日本エイズ学会学術集会(2016年11月24-26日、鹿児島)
シンポジウム講演
武内 寛明、俣野 哲朗.
エイズウイルスの異種間感染メカニズム ~新興・再興感染症に対する新規治療および予防法の確立に向けて~
第22回日本エイズ学会学術集会(2008年11月26-28日、大阪)
シンポジウム講演
武内 寛明. SIVagm Vif targets novel APOBEC-independent viral restriction factors in human cells
第53回日本ウイルス学会学術集会(2005年11月20-22日、横浜)
ワークショップ発表
*Main contribution
§Corresponding author
