山岡 昇司
Shoji YAMAOKA M.D.Ph.D.
教授 / Professor
shojmmb at tmd.ac.jp
Virus-cell interaction, Lentivirus vector production
山岡昇司の履歴書

研究内容
最先端技術によるウイルス感染・情報伝達分子研究法
(1)君はウイルス感染を左右する細胞因子を知りたい?
(2)君は遺伝子治療に貢献するウイルスベクター開発に興味がある?
(1)ウイルス複製をコントロールする宿主細胞因子の研究
分子生物学的手法による遺伝子クローニングの競争はきびしく、標的として何を選ぶかと、その戦略が明暗を分ける。世界中で細胞遺伝子の機能を求めて一日24時間実験室は稼働している。その方法は生化学的精製、proteomics、yeast two hybrid法、遺伝学的手法, et cetera…と実に様々であるが、どの方法にも一長一短があることを知らなければならない。と同時に目標とする遺伝子に到達するのに最もふさわしい手法が何かを見抜かなければならない。注目した細胞やウイルスの制御がゲノム・RNA・蛋白質のどの段階でなされるかによるからである。我々はいかなる手法であれ、目標に最も適した手法をとることに躊躇しない。
私たちの採用する方法のひとつは、発現クローニング法である。まず細胞に変異原処理するか遺伝子発現ライブラリーを導入してシグナルが変化した細胞を樹立する。その変化が何らかの蛋白質の機能不全・消失にもとづくものならば、この細胞にcDNAライブラリーを導入して正常復帰した細胞を選べばよく、あらかじめcDNA発現ライブラリーを導入してある場合にはそのcDNAを回収すればシグナル伝達やウイルス感染に必須な因子の遺伝子をクローニングすることができる(Yamaoka et al. Cell 93 1231-1240, 1998)。この方法の美しい点は、実験経過がすなわち機能証明になっているところである。難点は、たったひとつの遺伝子に到達するのが最後の最後であることである。学問にも実験にも王道はない。遺伝子クローニングではどんな方法にもどこかに煩雑なステップはあるが、重要なことはできれば実験の早い段階で遺伝子産物の機能的保証が得られることである。細胞の選択法が十分にpowerfulであれば1億個以上の細胞から変異細胞・正常復帰細胞をとることは決して困難ではない。それは、いかにノイズの低い細胞選択法を作り上げられるかにかかっているのである。最初からcDNAやランダムペプチド発現ライブラリーをレトロウイルスで導入する場合はこれをゲノムからPCRで回収するのだが、より正確な情報を得るにはここに一工夫も二工夫も知恵をしぼる。
私たちはそのような細胞選択システムを作るのに成功し、エイズの原因ウイルス(HIV-1)が感染しにくい細胞を樹立した。もともと感染しやすい細胞がたった1種類のcDNAを発現することによって、あるいはたった一つの遺伝子をノックアウトすることで、ウイルスのライフサイクル(別図1)が阻害されて著しく感染抵抗性になる(別図2)ことを見出している。
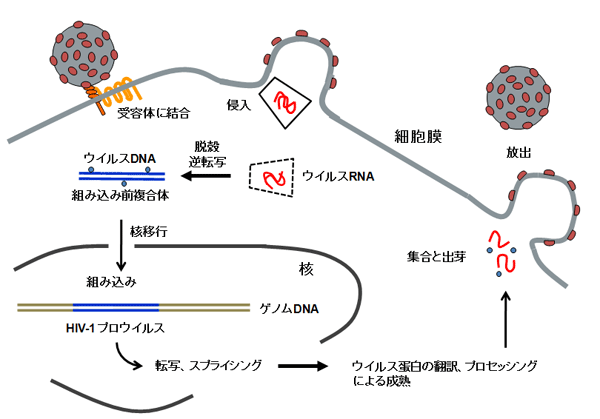
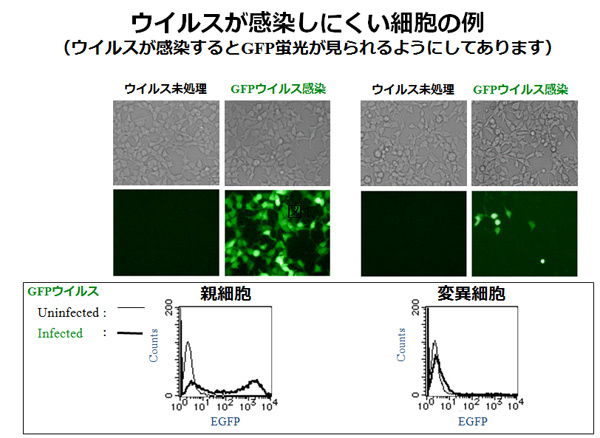
(2)レンチウイルスベクター産生法の開発研究
レンチウイルスベクターはHIVの病原性遺伝子を除いて複製できないようにすることで安全性を確立したウイルスベクターです。その需要は、単遺伝子異常性疾患やがん治療への応用によって広がる一方です。米国では急性リンパ性白血病、B細胞リンパ腫などの血液腫瘍の治療への応用がすでに承認され、様々な単一遺伝子異常性疾患の治療でも治験段階で画期的な成果を挙げています。ところが、このウイルスベクターは大量生産が困難で、プラスミド精製、細胞培養、細胞への導入に使う試薬、ウイルスの濃縮と精製に莫大なコストがかかるため、そのことが大量のレンチウイルスベクターが必要となる動物実験、ヒトでの治験、実際の患者治療の大きな足かせとなっています。
我々は、同じ培養規模でウイルスの産生効率を10倍にすればコストが大幅に下がり、それはより安価な治療費に反映され、より幅広く多くの患者を救済することができるようになるのではないか、との期待をこめて、これまでのHIV研究でたくわえたあらゆる知見と技術をつぎ込んで研究を開始しました。
どんな実験?
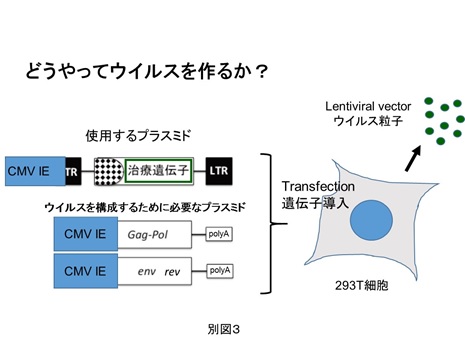
レンチウイルスベクターは、3種類以上の別々のプラスミドをいっしょに細胞へ導入(トランスフェクション)することで作製します(別図3)
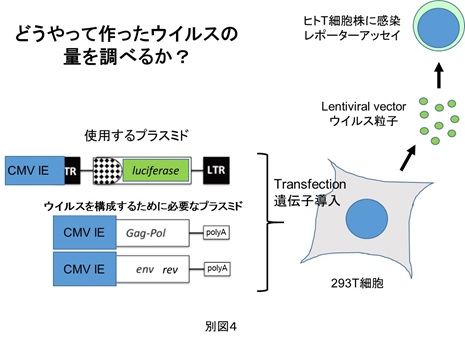
できた感染性をもつレンチウイルスベクターの量を知る目的で、本来治療用遺伝子が入っているところをルシフェラーゼという酵素の遺伝子に置き換えて、これが標的細胞でどれくらい発現したかを自然発光量として測定する実験系を我々は用いています(別図4)。
一見複雑そうに見えますが、細胞と遺伝子の取扱と手順に習熟すれば、大学院生がひとりで実験することができます。すでに2種類の転写因子を組み合わせて共発現させることでレンチウイルスベクターの産生量を10倍程度増やすことができる、という研究結果を得ています。これらをもとに遺伝子ノックアウトなどさらに工夫を加えて、安定・安全なレンチウイルスベクター産生法を確立したいと考えています。
この研究から期待されること
より効率的にレンチウイルスベクターを作製することができるようになれば、医療応用の幅はこれまで考えられていたよりもずっと広がるでしょう。どうすればウイルス産生を増やせるか、という研究は裏を返せば、どうすればHIV複製を抑えることができるか、という研究にもつながっています。その意味では、HIVの基礎研究に貢献する可能性も秘めています。
このような考え方、手法に関心ある多くの熱意ある大学院生の参加を期待します。
教授・山岡昇司
